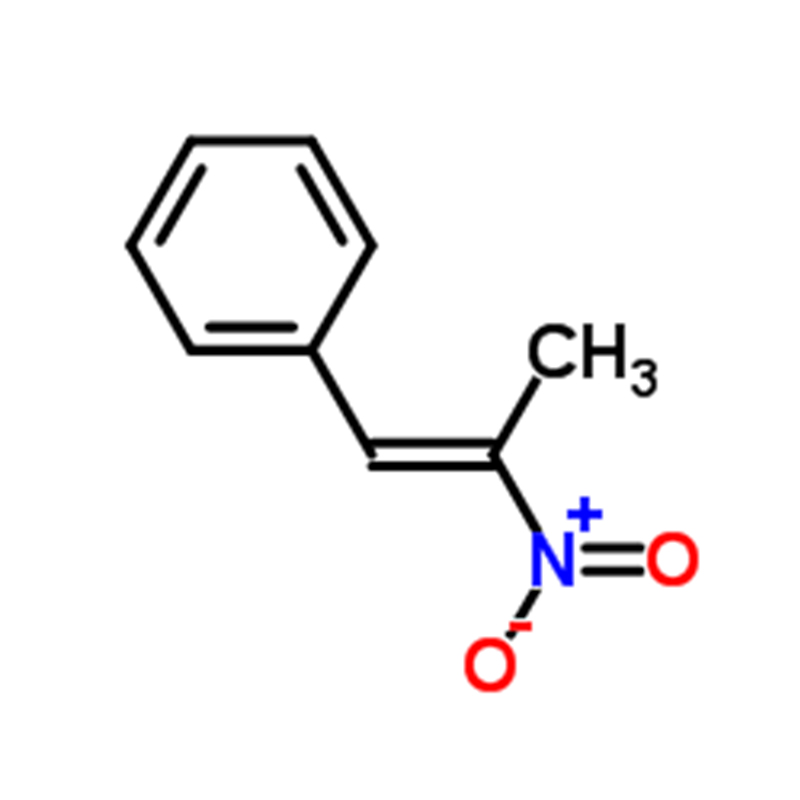
Dimethyl yellow CAS:60-11-7 Yellow to Orange to brown powder
| Numero ng Catalog | XD90467 |
| pangalan ng Produkto | Dimethyl dilaw |
| CAS | 60-11-7 |
| Molecular Formula | C14H15N3 |
| Molekular na Timbang | 225-29 |
| Mga Detalye ng Storage | Ambient |
| Harmonized Tariff Code | 29270000 |
Produkto detalye
| Temperatura ng pagkatunaw | 105-116 Deg C |
| Hitsura | Dilaw hanggang Kahel hanggang kayumanggi pulbos |
| Pagsusuri | 99% |
| Pagkawala sa Pagpapatuyo | <1.0% |
| Lakas | 98.67% |
| Pagbabago ng Kulay | Pula @ pH 2.9, Dilaw @ pH 4.9 |
| Sulfated na abo | 0.4% |
| Lamda Max | 400nm (sa methanol) |
Ang topology ng lamad ng colicin E1 channel domain ay pinag-aralan ng fluorescence resonance energy transfer (FRET).Ang FRET ay nagsasangkot ng genetically encoded fluorescent amino acid (coumarin) bilang donor at isang selectively labeled cysteine residue na nakatali sa DABMI (4-(dimethylamino)phenylazophenyl-4'-maleimide) bilang FRET acceptor.Ang fluorescent coumarin residue ay isinama sa protina sa pamamagitan ng isang orthogonal tRNA/aminoacyl-tRNA synthetase pares na nagpapahintulot sa pumipili na pagsasama sa anumang site sa loob ng domain ng colicin channel.Ang bawat variant ay mayroong stop (TAG) mutation para sa coumarin incorporation at cysteine (TGT) mutation para sa DABMI attachment.Ang anim na interhelical na distansya sa loob ng mga helice 1-6 ay natukoy gamit ang pagsusuri ng FRET para sa parehong natutunaw at nakagapos na mga estado.Ang data ng FRET ay nagpakita ng malalaking pagbabago sa mga interhelical na distansya sa pagitan ng mga helice 3-6 sa samahan ng lamad na nagbibigay ng bagong pananaw sa istrukturang nakagapos sa lamad ng domain ng channel.Sa pangkalahatan, ang coumarin-DABMI FRET interhelical na kahusayan ay nabawasan sa pagbubuklod ng lamad, na binuo sa modelo ng payong para sa colicin channel.Ang isang pansamantalang modelo para sa saradong estado ng domain ng channel ay binuo batay sa kasalukuyan at dati nang na-publish na data ng FRET.Ang modelo ay nagmumungkahi ng pabilog na pag-aayos ng mga helice 1-7 sa isang clockwise na direksyon mula sa extracellular side at membrane interfacial association ng mga helice 1, 6, 7, at 10 sa paligid ng gitnang transmembrane hairpin na nabuo ng mga helice 8 at 9.



![3,3′,5,5′-Tetramethyl-[1,1'-biphenyl]-4,4′-diamine Cas:54827-17-7 99%](http://cdn.globalso.com/xdbiochems/54827-17-71.jpg)